如果將腫瘤比喻為一座堅不可摧的“堡壘”�����,而溶瘤細菌則如同英勇無畏的攻城“戰士”,一旦下達攻城指令,“溶瘤細菌戰士”便井然有序、齊心協力地發起猛烈攻擊����,最終成功攻破“腫瘤堡壘”�����。
實體瘤內部的低氧和免疫抑制微環境,嚴重阻礙了藥物分子和免疫效應細胞的浸潤,成為惡性實體瘤難以根治的關鍵挑戰����。然而����,自然界中一些獨特的“溶瘤細菌”(如大腸桿菌�、沙門氏菌、李斯特菌等)卻能夠精準靶向腫瘤內部的缺氧和免疫抑制區域,通過激活先天免疫系統��,展現出抗腫瘤潛力��。

通過合成生物學思想�,科學家們通過對細菌進行工程設計�、重編程改造,將其升級為“智能活體藥物工廠”����,能夠在腫瘤原位按需可控高效地表達輸送多種抗腫瘤藥物�����,為腫瘤治療提供了全新視角���。然而,工程化“溶瘤細菌”在腫瘤治療中的應用仍面臨一個重要挑戰:如何在復雜生理環境下實現治療蛋白質表達的動態平衡與精準時空控制?為此��,開發一種能夠遠程控制細菌基因表達的精準調控系統�,已成為當前的迫切需求,也是實現安全高效治療的關鍵突破點。
3月17日,華東師范大學生命科學學院葉海峰和管寧子團隊在Nature Cancer上發表題為“Engineered bacteria for near-infrared light-inducible expression of cancer therapeutics” 的研究成果。該研究成功打造出一種能夠響應近紅外光的“溶瘤細菌”, 為實體瘤治療提供了全新策略。

▲Nature Cancer刊發華東師大學生命科學學院葉海峰和管寧子團隊聯合研究成果
Nature Cancer同期配發了Research Briefing,推薦了該最新研究成果��。該雜志編輯高度評價:“該研究脫穎而出�,因為它描述了一種巧妙的近紅外光誘導細菌基因表達策略。” 德克薩斯大學安德森癌癥中心的Konstantin Sokolov教授評論該工作:“這是一項針對實體瘤治療的新型細菌活體療法的全面研究�,” 并認為:“該論文在該領域取得了重要進展�����。”
· 傳統療法的“隱性壁壘”
如果把實體腫瘤比作一座“缺氧且布滿防御工事的堡壘”,那么它的核心區域就像被層層保護的密室——這里不僅氧氣稀薄�,還充斥著大量“麻痹”免疫細胞的抑制信號�,讓傳統藥物和免疫細胞都難以攻入�。有趣的是,自然界中有一群“厭氧特工”(比如某些間性厭氧菌),它們天生自帶“腫瘤導航系統”,能穿越復雜地形��,精準潛入腫瘤核心的缺氧密室安營扎寨��,甚至就地繁殖�。這就像在敵人心臟地帶安插了微型機器人�����,給抗癌治療帶來了全新可能����。
但這場“細菌特工行動”仍有致命弱點:這些微型機器人自身戰斗力不足�,像一群沒有指揮官的散兵,誰也無法給他們下達統一作戰指令,缺乏“遠程遙控開關”進行發號施令。
為此����,科學家們給這些細菌特工裝上了“近紅外光控操作系統”(NETMAP系統)���。近紅外光能穿透皮膚“隔空發令”,指揮細菌同步生產抗癌導彈(如各種抗體藥物���、細胞因子、腫瘤殺傷蛋白)等多種武器�,甚至能在治療后一鍵啟動“自毀程序”�。這套“光控制藥流水線”既保證了精準打擊����,又避免了誤傷友軍,讓細菌療法真正成為對抗實體瘤的智能生物武器�。
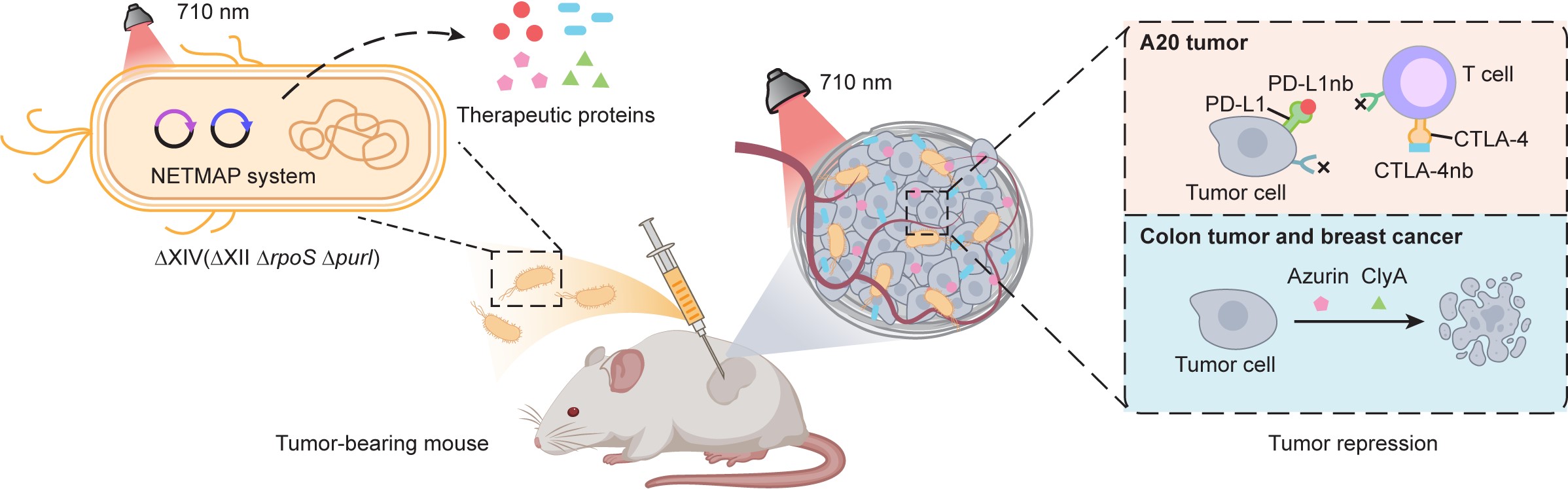
▲圖1:NETMAP系統工程改造的“溶瘤細菌特工”在腫瘤內定植并增殖�����。在710 nm近紅外光指令下,根據腫瘤的類型定制化生產“抗癌導彈”�。
· 光控“細菌特工”:近紅外光指揮作戰
科研人員給這些細菌特工做了一次高科技升級——在它們體內安裝了“光控生物開關”���!研究人員巧妙地將能感應近紅外光的光敏蛋白(PadC)嵌入細菌基因組�����。當特定波長的近紅外光穿透皮膚照射腫瘤,這個開關會立即啟動細菌的“制藥流水線”���,讓它們化身微型細胞藥物工廠,按需生產抗癌導彈(如免疫激活劑)�����、破墻炸藥(基質降解酶)等不同武器�。更酷的是,這套名為NETMAP的“光子指揮系統”還能通過調節光照強度和時間���,精準控制藥物產量,真正實現“指哪打哪�,要多少造多少”的智能抗癌作戰�。
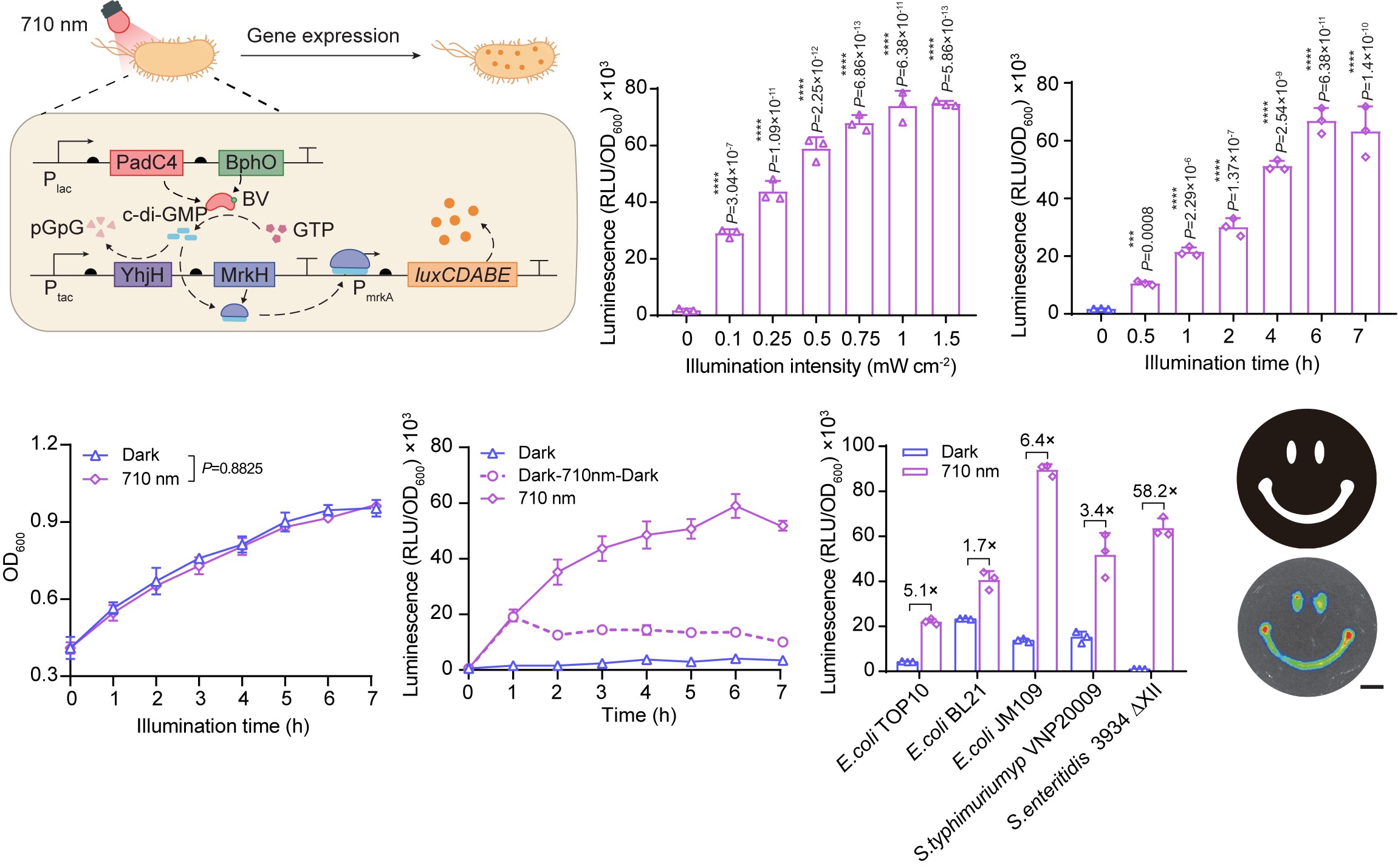
▲圖2:NETMAP系統的近紅外光響應動力學特性��,包括光照時間依賴性��、光照強度依賴性、可調性���、普適性以及空間特異性。
· 雙重保險:細菌的“安全模式”與精準治療策略
在此基礎上��,研究團隊進一步開發出新型減毒沙門氏菌株ΔXIV�����,通過精準敲除rpoS���、purI及c-di-GMP相關基因簇(共15個基因)顯著降低了毒副作用�����,展現出優異的生物安全性,同時保持了強大的腫瘤靶向能力和瘤內增殖活性���,為腫瘤生物治療提供了雙重保障。
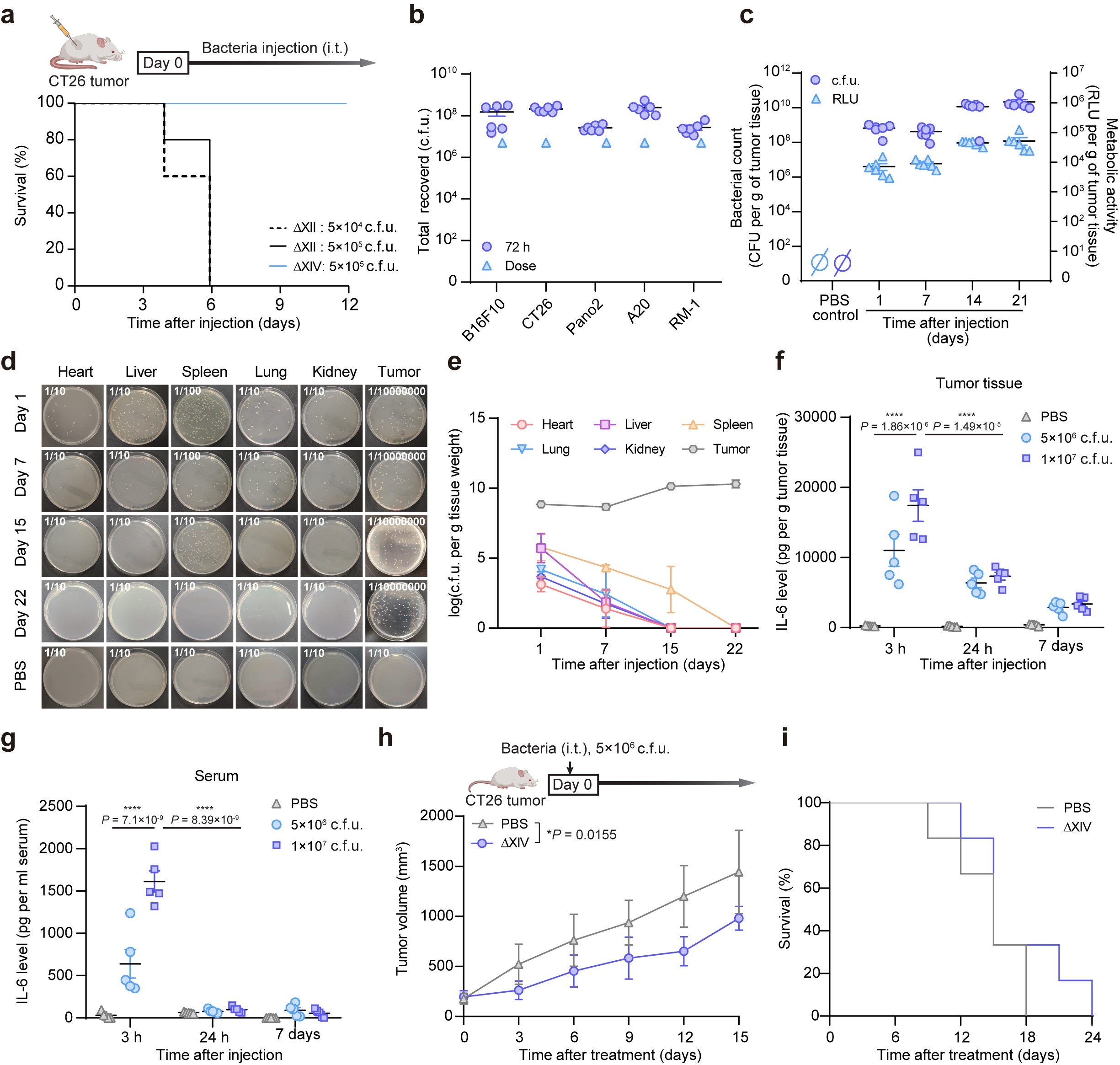
▲圖3:新型減毒沙門氏菌株ΔXIV在體內展現出生物安全性�。
基于腫瘤免疫原性的差異�����,研究人員開發了智能化的精準治療策略:針對高免疫原性腫瘤,系統可精準釋放CTLA-4和PD-L1免疫檢查點抑制劑�,激活機體免疫應答����;而對于低免疫原性腫瘤�,則選擇性輸出azurin和clyA細胞毒性蛋白,直接殺傷腫瘤細胞�����。這種“智能切換�、量體裁衣”式的精準治療策略在多種腫瘤模型中展現出卓越的療效�����,包括皮下淋巴瘤模型(A20)�、結腸癌模型(CT26)����、深部腫瘤模型——原位結腸癌模型(CT26)以及人源乳腺癌CDX模型(MCF-7)等。尤為重要的是,為更貼近臨床實際��,研究團隊成功構建了結直腸癌患者來源的異種移植模型(PDX)����,進一步證實了該策略的臨床轉化價值,為腫瘤精準治療領域提供了創新性的解決方案。
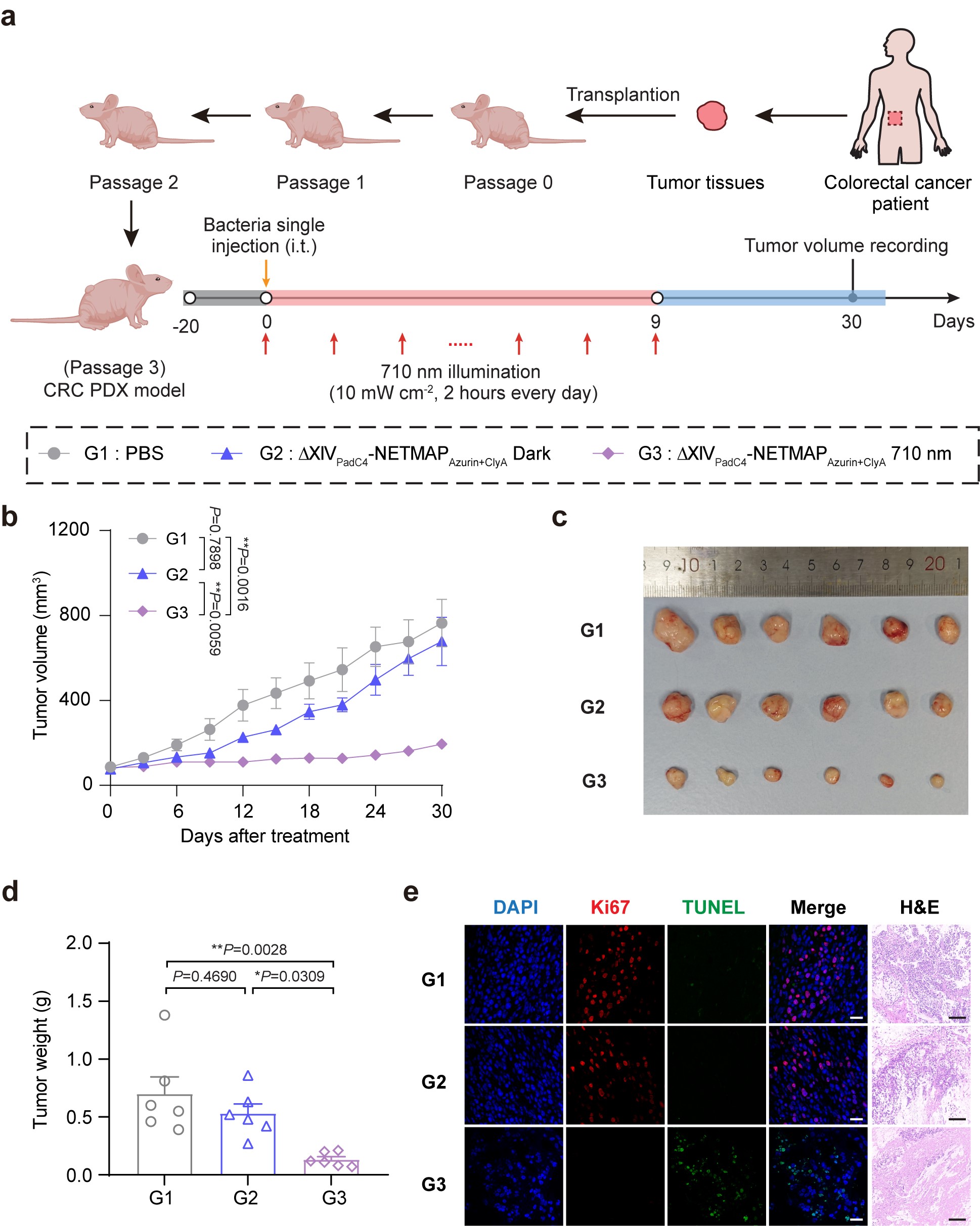
▲圖4:NETMAP工程改造的溶瘤細菌對結直腸癌患者來源的異種移植(PDX)模型具有抑制效果�����。
該研究工作開發了“精準可控��、智能遞送��、協同治療”的下一代光控溶瘤細菌系統。華東師范大學生命科學學院、上海市調控生物學重點實驗室��、醫學合成生物學研究中心研究員葉海峰表示����,溶瘤細菌就像一支訓練有素的微型細胞機器人戰士,一旦接收到信號(近紅外光),便迅速展開行動����,精準釋放出的武器(治療蛋白)�����,攻擊癌細胞�����,使其土崩瓦解�。這種創新的治療方式,猶如為癌癥治療裝上了一個智能導航系統�����,讓藥物精準空投到腫瘤‘指揮部’�����,推動癌癥治療邁向更加精準的未來���。

華東師范大學生命科學學院2023屆博士畢業生喬龍亮(目前為同濟大學博士后)�����,2022級博士研究生牛靈雪,2023級博士研究生王智浩為共同第一作者,葉海峰研究員�,管寧子副研究員和同濟大學附屬同濟醫院乳腺外科蔡豐豐主任為論文的通訊作者���。該研究受到了國家自然科學基金委��、上海市科委合成生物學專項、上海市“尚思探索學者”項目資助����。
本文參考文獻:
[1] Binnewies M. et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nat Med. 24(5):541-550 (2018).
[2] Kwon, S. Y. et al. Exploiting bacteria for cancer immunotherapy. Nat Rev Clin Oncol. 21(8):569-589 (2024).
[3] Zhou, S. et al. Tumour-targeting bacteria engineered to fight cancer. Nat Rev Cancer. 18, 727-743 (2018).
論文鏈接:https://doi.org/10.1038/s43018-025-00932-3
來源|生命科學學院�����、科技處 編輯|徐心成�����、沈韻婷 編審|郭文君
