自然殺傷細胞(NK)是人體免疫系統中重要的“先天抗癌戰士”,它們能夠識別并殺死癌細胞,在控制惡性腫瘤和感染中起著至關重要的作用���。相較于T細胞,NK細胞能夠靶向MHC(或HLA)分子缺陷的腫瘤細胞,通過釋放細胞毒性穿孔素和顆粒酶誘導細胞凋亡����,且在過繼細胞治療中不會引起免疫排斥�����,因而在抗腫瘤免疫細胞治療中具有很大潛力。然而,低氧腫瘤微環境(TME)通過代謝產生大量乳酸��,抑制NK細胞功能�����,導致其抗癌能力下降��。GPR132屬于質子感應GPCR受體家族的一員,能夠感應酸性環境,并傳遞信號進入細胞���,影響細胞生長、代謝和遷移等過程,在調節免疫細胞功能中起著至關重要的作用,但GPR132對NK細胞的影響機制尚未見報道���。華東師范大學生命科學學院江文正教授團隊長期致力于探究GPCRs在NK細胞免疫調控中的功能與分子機制,以及CAR-NK細胞療法治療實體瘤的技術突破����,實驗室具有成熟的藥物靶點開發體系和細胞治療技術平臺����。
江文正教授團隊近期研究揭示了GPR132對NK細胞功能的調控作用及其機制��,并將其應用于CAR-NK細胞對結直腸癌的治療中���,這一發現為實體瘤的治療提供了新的思路和策略�。該研究成果于2025年3月5日以“GPR132 regulates the function of NK cells through the Gαs/CSK/ZAP70/NF-κB signaling pathway as a potential immune checkpoint ”為題在 Science Advances 上發表���。

Science Advances 刊發華東師范大學江文正團隊最新研究成果
研究團隊首先通過RNA-seq發現����,在激活的NK細胞中,GPR132的表達水平顯著下降,預示GPR132與NK細胞功能相關�。為了探究GPR132對NK細胞功能的影響��,研究人員利用GPR132基因敲除小鼠模型,發現與WT小鼠相比,GPR132敲除小鼠具有更多成熟的NK細胞�,且具有更強的抗腫瘤能力��。
進一步體外研究表明,GPR132干擾的NK92細胞表達更多的顆粒酶B(GzmB)和IFN-γ等活化因子,表現出更強的細胞毒性能力���。反之,利用GPR132特異性激動劑ONC212處理后���,NK92細胞的功能減弱。腫瘤微環境中的乳酸能夠抑制免疫細胞的抗腫瘤效果���,研究人員為了驗證GPR132對乳酸的敏感性,用乳酸處理GPR132敲低的NK92細胞����,證明GPR132的敲低可以減弱乳酸對NK細胞的抑制作用��。
機制上,研究團隊證明GPR132通過Gαs/CSK/ZAP70/NF-κB信號軸調節NK細胞功能。最后,研究團隊構建了GPR132基因敲低的NKG2D-CAR-NK92細胞�,在體內外實驗中均展現出優越的抗結直腸癌效果���。
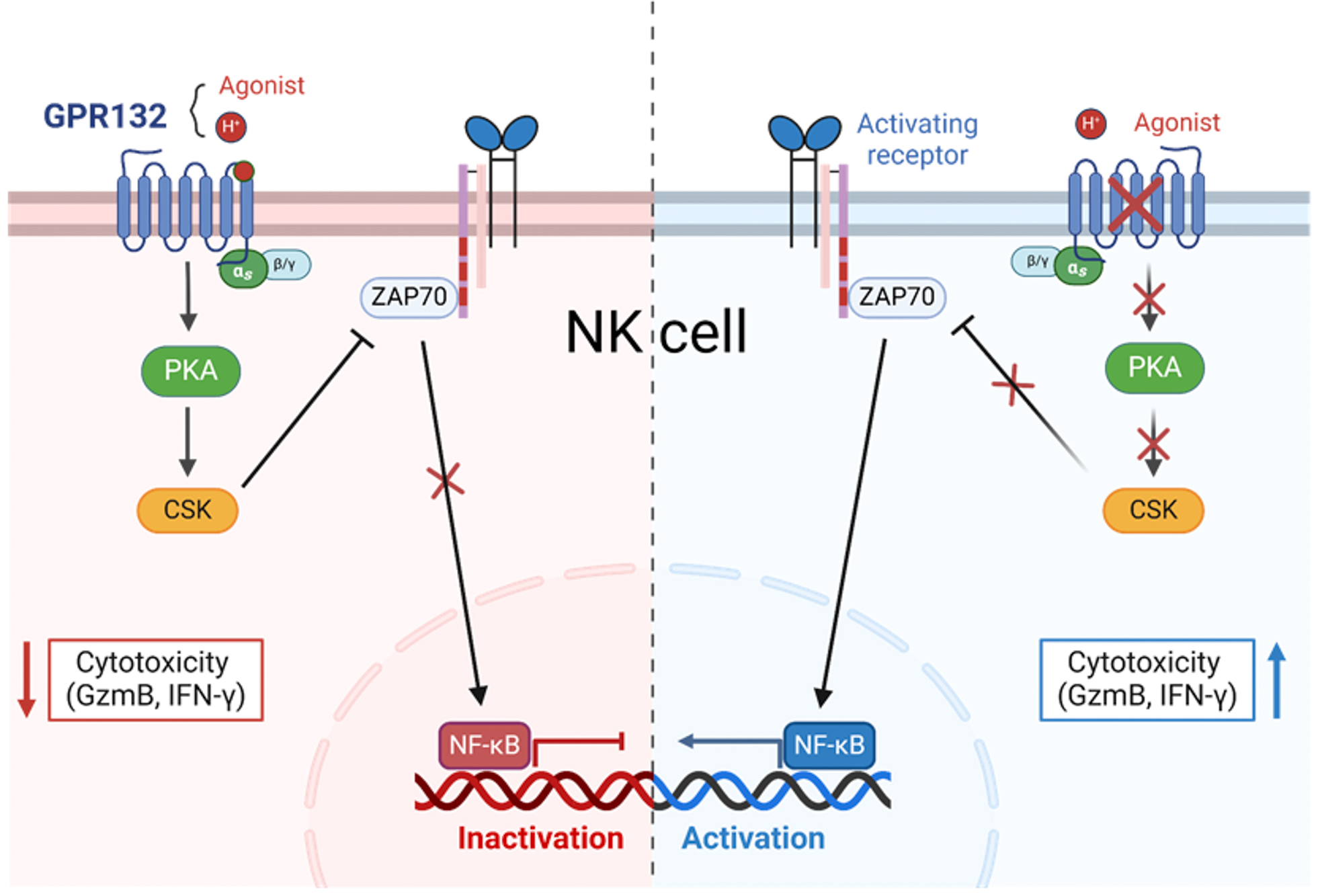
GPR132調控NK細胞的機制模式圖
最后,研究團隊進一步將GPR132敲低技術與CAR-NK細胞療法結合�。結果顯示����,靶向NKG2DL的CAR-NK細胞在敲低GPR132后���,對結直腸癌細胞的殺傷能力顯著增強����,且在乳酸環境中仍保持高效活性。動物實驗中����,GPR132敲低的CAR-NK細胞具有更好的治療效果�����。
綜上,該研究揭示了GPR132負調控NK細胞功能的機制���,證明了GPR132可以作為潛在的免疫檢查點。此外��,GPR132的缺失能夠降低NK細胞的乳酸敏感性�����,為增強NK細胞抵抗腫瘤微環境免疫抑制的能力提供了新的思路和途徑����。

華東師范大學生命科學學院江文正教授指導學生實驗

薛敏(左)�����、江文正教授(中)�、惠心慧(右)
華東師范大學生命科學學院博士研究生惠心慧和碩士研究生薛敏為該論文的共同第一作者,華東師范大學江文正教授為本文的通訊作者���。該研究受到了國家自然科學基金、上海市科學技術委員會����、國家重點研發計劃項目�、國家藥品監督管理局治療性單克隆抗體質量控制重點實驗室開放基金等項目的支持�。
附:
論文鏈接:https://www.science.org/doi/10.1126/sciadv.adr9395
來源|生命科學學院、科技處 編輯|毛宇彤 編審|郭文君
