原發性高草酸尿癥1型(PH1)是一種罕見的遺傳代謝疾病�����,由于Agxt基因突變,肝臟中負責乙醛酸代謝的生產線出現故障��,導致草酸這種“廢料”過量生成��。這些過量的草酸在腎臟中就像多余的積木����,容易與鈣結合��,形成草酸鈣結晶�,進而引發腎鈣質沉著和腎功能逐漸下降��,最終可能發展為終末期腎?����。‥SRD)。如果不及時治療���,草酸還可能在全身多個器官中沉積,造成嚴重的“堵塞”現象���,危及生命。
目前��,靶向乙醇酸氧化酶(GO)的siRNA藥物已在臨床應用����,但其高昂的費用和需要重復給藥的限制給患者帶來了巨大的經濟負擔。
2024年10月�����,華東師范大學生命科學學院的吳宇軒研究員與堯唐生物合作�����,開發了一種脂質納米顆粒(LNPs)介導的體內基因編輯策略靶向敲降GO,成功在PH1小鼠體內實現了高效的基因編輯和穩定的降草酸效果�。該研究成果以“Efficient and Safe In Vivo Treatment of Primary Hyperoxaluria Type 1 via LNP-CRISPR/Cas9-mediated glycolate oxidase disruption”為題��,在線發表在《分子療法》期刊上。這一創新性方法首次將LNPs介導的體內基因編輯技術應用于PH1的治療,克服了siRNA頻繁給藥的困擾及AAV載體的安全性問題��,實現了一次給藥便可長期獲益的效果,為PH1的治療開辟了新方向��。

《分子療法》報道華東師大吳宇軒研究員團隊研究成果
為了快速建立PH1模型小鼠��,研究團隊通過LNPs遞送Cas9 mRNA和靶向Agxt的sgRNA��,并在小鼠飲用水中添加0.5% 乙二醇(EG),成功建立了PH1小鼠模型���,觀察到尿草酸水平升高及腎鈣質沉著,證實了建模方法的可靠性���。隨后,研究團隊篩選了靶向小鼠Hao1基因的高效sgRNA, 利用LNP和Cas9 mRNA/Hao1-4 gRNA通過靜脈注射以低高劑量在PH1小鼠體內驗證該治療策略的有效性�。在長達12個月的監測中��,治療組顯示出穩定的編輯效率和持久的治療效果,尿草酸水平均顯著下降���,且未觀察到腎鈣質沉著現象,提示該治療方法能顯著緩解PH1表型����。
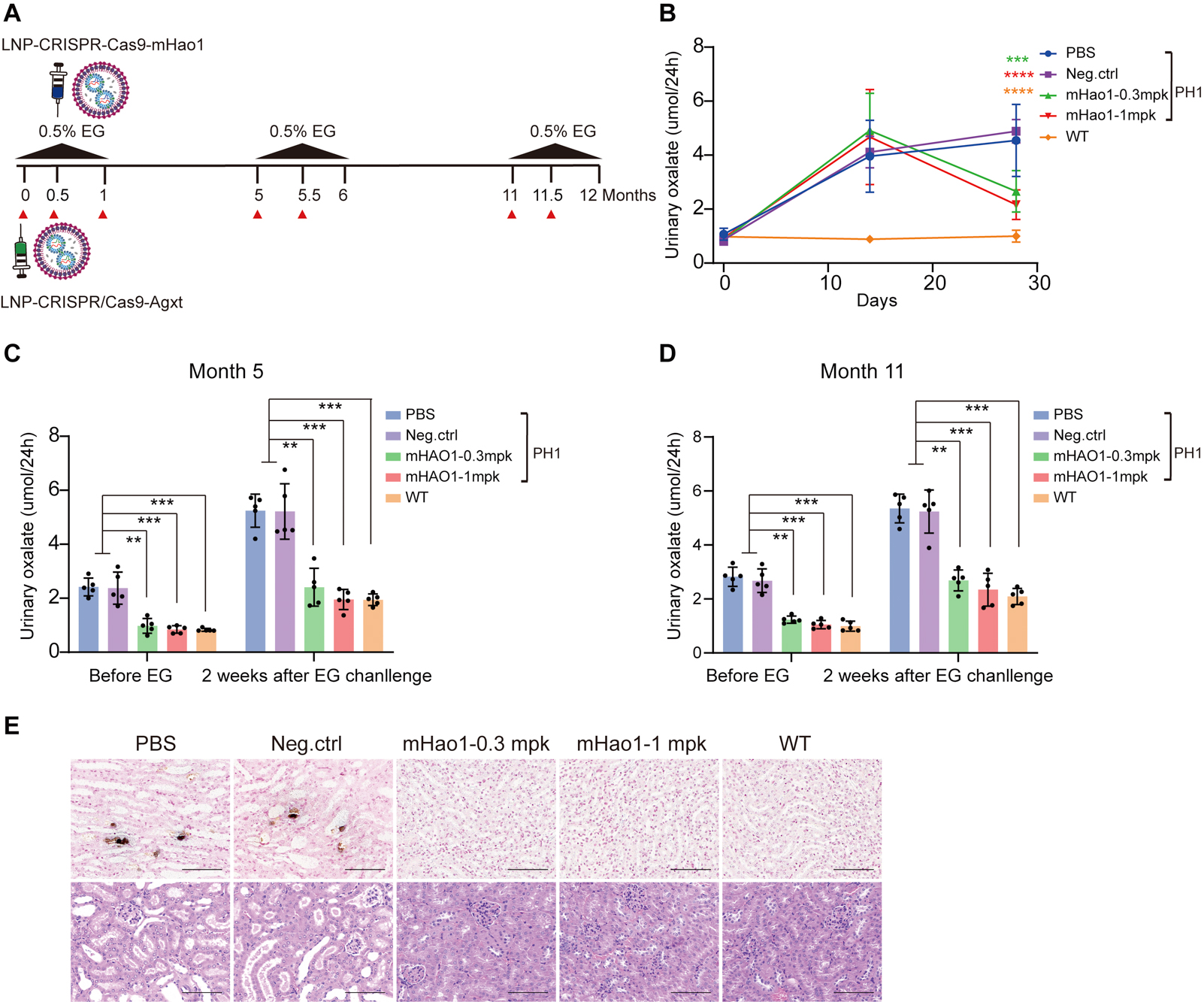
實驗結果-治療效果評估
為評估該治療方法的安全性�,研究人員從組織編輯分布��、脫靶分析�����、肝毒性及免疫反應等多個方面進行了全面檢測����。結果顯示,基因編輯活性主要集中在肝臟中,且脫靶效應極小。此外,未觀察到肝毒性或免疫反應的發生�����。這些結果表明��,該治療策略具有良好的安全性���,為其臨床應用奠定了基礎����。
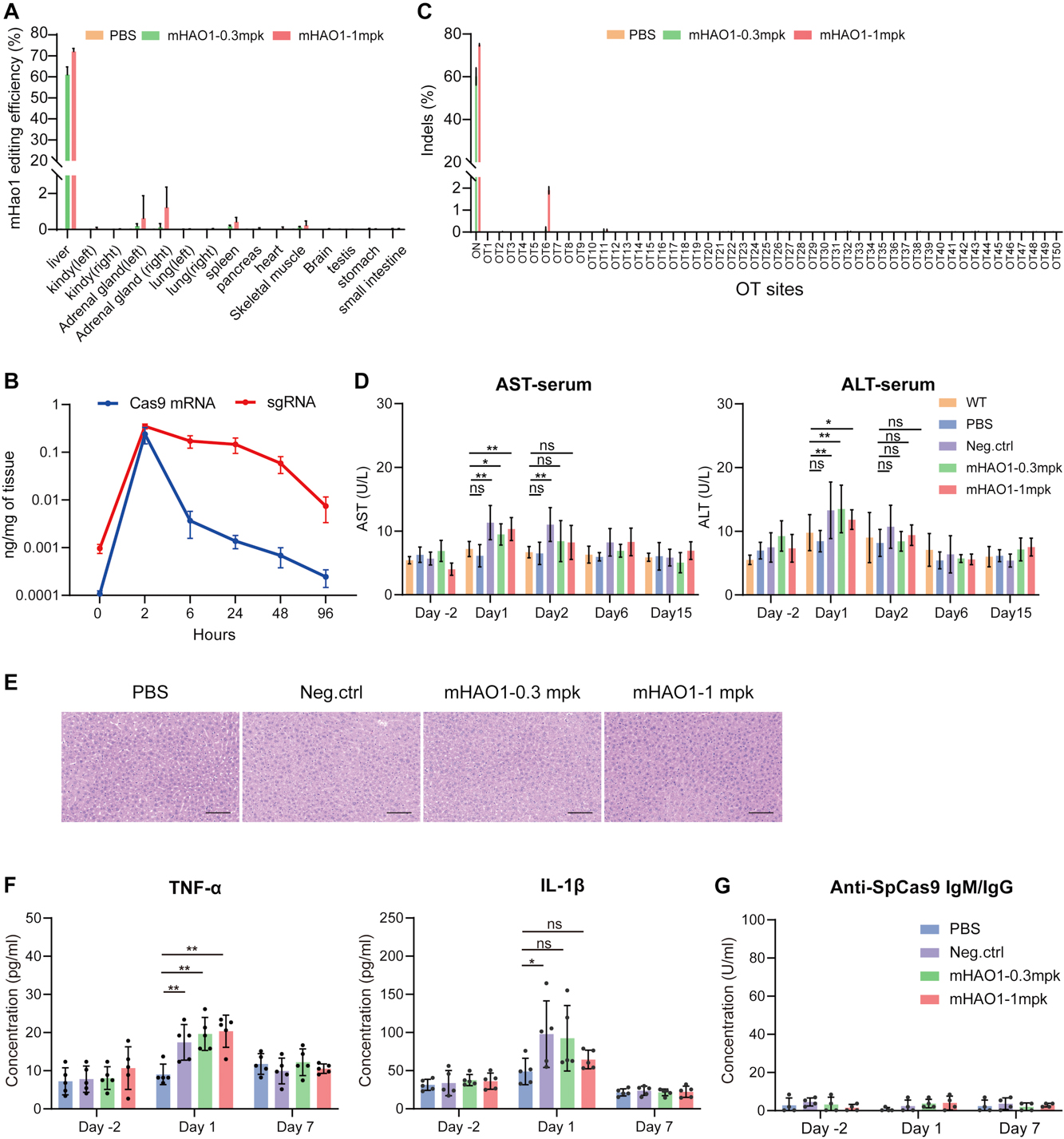
實驗結果-安全性評估
此外��,研究人員還構建了HAO1基因人源化小鼠��,并驗證了LNP介導的體內編輯策略在人源化小鼠中的編輯效率和治療效果。這項研究為PH1的臨床應用提供了重要的前瞻性依據����。在此基礎上�����,上海堯唐生物已成功開展針對PH1的臨床研究,并初步取得了優異的臨床效果。
本研究中使用的LNPs由上海堯唐生物提供����,其自主知識產權的新型脂質納米顆粒YOL-LNPs?實現了更高效的體內遞送���。值得一提的是,堯唐生物自主研發的首個針對ATTR的體內基因編輯藥物已于2024年3月獲得國家藥品監督管理局藥品審評中心(CDE)批準��,并于2024年6月成功完成首例患者入組��,標志著國內首個LNP介導的體內基因編輯藥物進入臨床階段��。
博士研究生蔣艷紅、副研究員陳雙紅和博士研究生蕭圣霖為共同第一作者�����。華東師范大學為第一單位���。華東師范大學吳宇軒研究員����、廖嬌陽副研究員和劉明耀教授為本文的共同通訊作者����。堯唐生物王子君博士對本項研究提供了重要支持���。該研究受到了科技部重點研發計劃��、國家自然科學基金以及上海市教委科技創新計劃等支持�����。
附:
論文鏈接:https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(24)00663-4
來源|生命科學學院、科技處 編輯|蔣萱 編審|郭文君
