華東師范大學生命科學學院研究員盧偉強和教授劉明耀研究團隊揭示了G蛋白偶聯受體(GPCR)家族成員HCAR1通過感知乳酸信號�,驅動腫瘤免疫逃逸的新機制��,并闡明乳酸受體HCAR1抑制劑在腫瘤免疫治療中的潛在應用價值����,為深入理解代謝物乳酸介導的腫瘤免疫逃逸機制提供了新視角�����,也為腫瘤免疫創新療法開發提供了新靶點和候選藥物����。2月4日����,相關研究發表于《自然—免疫》。
近十年來�����,免疫療法在腫瘤治療領域取得了突破性進展����,成為繼手術���、放療和化療之后的第四大治療范式。然而,現有的免疫療法整體響應率仍不足30%�����,且面臨個體差異大��、耐藥性強�����、誘發免疫相關不良反應等問題。深入解析腫瘤免疫逃逸機制并發現新型免疫治療靶點,已成為全球生命醫學研究的前沿熱點和亟待突破的重大科學問題���,對于改善腫瘤患者治療效果具有重要的臨床意義。
研究團隊發現��,乳酸通過激活其特異性受體HCAR1促進腫瘤細胞高表達趨化因子CCL2和CCL7��,從而招募具有強免疫抑制活性的多形核髓源性抑制細胞(PMN-MDSCs)進入腫瘤微環境�����。體內敲除HCAR1基因可顯著降低腫瘤組織中PMN-MDSCs的含量,增強T細胞介導的抗腫瘤免疫反應。
進一步研究表明���,已上市藥物利血平能夠有效抑制HCAR1的活化,減少腫瘤對PMN-MDSCs的募集作用,誘導T細胞依賴的抗腫瘤免疫作用。在小鼠腸癌模型中,利血平同樣表現出增敏現有免疫療法�、發揮強效抗癌效果的作用�����。
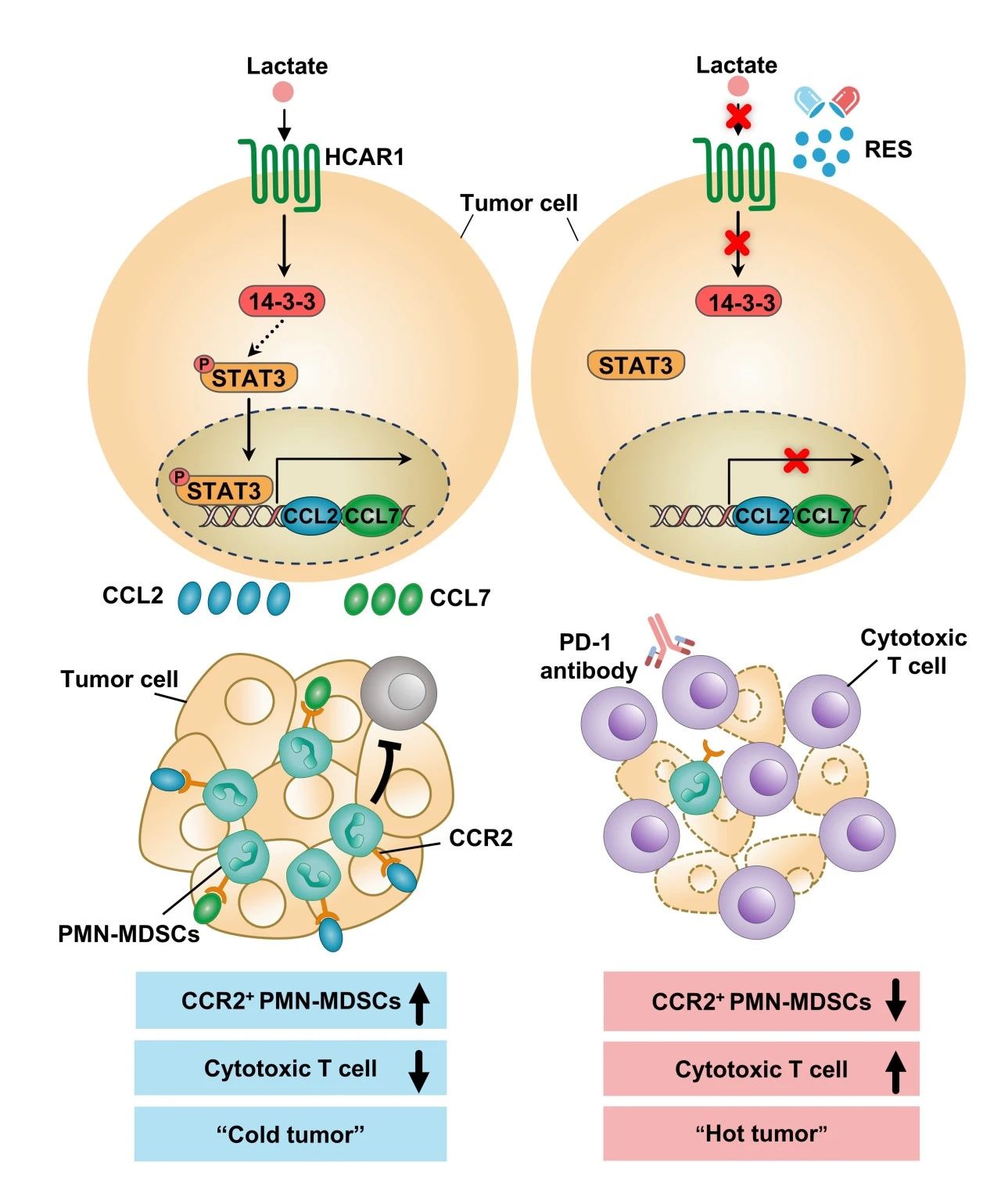
研究圖示。圖片由研究團隊提供
相關論文信息:https://doi.org/10.1038/s41590-024-02068-5

閱讀原文
來源丨科學網
編輯丨王越月
編審丨郭文君
