離子通道具有廣泛且重要的生理和病理功能,是藥物靶標(biāo)和潛在藥物靶標(biāo)的重要來源。為了解決靶向離子通道藥物發(fā)現(xiàn)的堵點(diǎn)問題,華東師范大學(xué)生命科學(xué)學(xué)院和藥學(xué)院陽懷宇課題組持續(xù)構(gòu)建離子通道新調(diào)控理論,提出跳出靜態(tài)結(jié)構(gòu)的局限,從離子通道動態(tài)構(gòu)象中尋找調(diào)控機(jī)遇。該團(tuán)隊與合作者發(fā)現(xiàn)小分子不僅可以靶向離子通道自有動態(tài)構(gòu)象,還可以創(chuàng)造離子通道新構(gòu)象。近日,陽懷宇教授、張乾森青年研究員與浙江大學(xué)基礎(chǔ)醫(yī)學(xué)院郭江濤研究員開展深入合作,在利用小分子創(chuàng)造離子通道構(gòu)象和電生理功能研究中取得新突破,發(fā)現(xiàn)可誘導(dǎo)非失活類的電壓門控鉀通道 KCNQ2 產(chǎn)生失活態(tài)的小分子,揭示了小分子誘導(dǎo)激活態(tài)產(chǎn)生門控關(guān)閉的新型抑制機(jī)制,研究成果于2025年1月15日以“Small molecule inhibits KCNQ channels with a non-blocking mechanism”為題在線發(fā)表于 Nature Chemical Biology 雜志。
電壓門控離子通道是重要藥物靶標(biāo)來源,超過10%的現(xiàn)有藥物作用于該類通道,因此揭示靶向電壓門控通道的新型調(diào)控機(jī)制對于藥物開發(fā)和新靶標(biāo)鑒定均具有重要意義。鑒于電壓門控類離子通道序列和結(jié)構(gòu)存在相似性,該 KCNQ2 通道研究工作發(fā)現(xiàn)的調(diào)控位點(diǎn)和調(diào)控機(jī)制可直接啟發(fā)靶向其他電壓門控類通道的抑制劑設(shè)計。

華東師大和浙江大學(xué)聯(lián)手開辟離子通道抑制劑類藥物研發(fā)新路徑
藥物研發(fā)的經(jīng)典范式是尋找增強(qiáng)或減弱蛋白質(zhì)生理功能的外源性分子,對應(yīng)的分子作用機(jī)制是外源性分子與蛋白質(zhì)自有結(jié)構(gòu)或動態(tài)構(gòu)象產(chǎn)生結(jié)合。而該工作開辟了新路徑,證明可利用小分子創(chuàng)造離子通道的新功能形態(tài),不只是上調(diào)或下調(diào)蛋白質(zhì)自有功能。
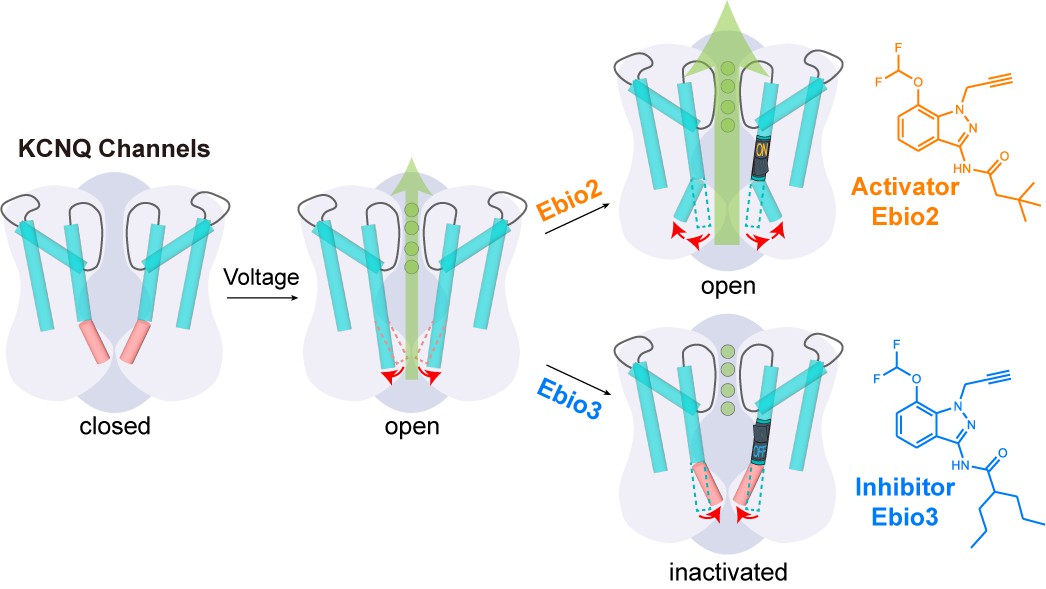
新型激動劑和新型抑制劑作用機(jī)制的對比
該論文第一作者是華東師范大學(xué)研究生李俊男,浙江大學(xué)研究生楊珍妮,華東師范大學(xué)研究生張少英和中科蘇州藥物研究院葉陽亮博士。通訊作者為華東師范大學(xué)陽懷宇教授、張乾森青年研究員和浙江大學(xué)郭江濤研究員。該研究受到國家重點(diǎn)研發(fā)計劃戰(zhàn)略性科技創(chuàng)新合作重點(diǎn)專項和中央高校基本科研業(yè)務(wù)費(fèi)等基金的資助。
附:
論文鏈接:https://www.nature.com/articles/s41589-024-01834-8
來源|科技處、生命科學(xué)學(xué)院 編輯|鄧安之 編審|郭文君