日前,華東師范大學生命科學學院李大力團隊報道開發出了一種全新的基于 IscB 的超高活性、且體積更小的基因編輯工具并率先實現了小鼠體內高效編輯,該項研究成果為多元化的基因治療策略提供了新的工具。2024年8月22日,國際知名學術期刊《分子細胞》在線發表李大力團隊這一研究成果,并被選為封面文章。

《分子細胞》在線發表李大力團隊科研成果

李大力團隊科研成果被選為《分子細胞》封面文章
《分子細胞》封面論文設計圖以中國風為封面主基調,長街上的兩列燈籠排列有序(代表DNA),小朋友(eIscB-D)踩著樓梯(eωRNA)去替換特定位置的燈籠(基因編輯),巧妙地呈現了基因編輯的奇妙景象。小朋友身形小巧玲瓏,一手敏捷地摘下舊燈籠,另一只手掛迅速掛上新燈籠,這一精準而迅速的替換動作,象征著eIscB-D高效、小巧、準確的特點,樓梯繪畫為多發卡結構,代表協助高效、精準定位的ωRNA。
|一款高活性且體積更小的基因編輯工具:具有極大的臨床應用價值
以 CRISPR/Cas9 為代表的基因編輯技術在過去的十年里屢屢獲獎,已成為當前炙手可熱的基因編輯工具,為基礎生物學和疾病治療帶來了重大變革。首個基于 CRISPR/Cas9 技術的離體(ex vivo)基因編輯療法 CASGEVY? 相繼在英國、美國、沙特及歐盟等4個國家獲批,標志著基因編輯技術已經邁進了臨床應用的時代。然而,CRISPR/Cas9 系統仍然存在著一定的局限性,如體積較大導致在體(in vivo)基因療法受到限制,又如目前適用于肝外基因遞送的主要載體是腺相關病毒(AAV),但其包裝上限僅4.7kb,單個病毒難以遞送 Cas9 等核酸酶及其衍生編輯系統,因此尋找尺寸更小的高活性基因編輯系統對于實現安全高效的體內遞送具有重大意義。
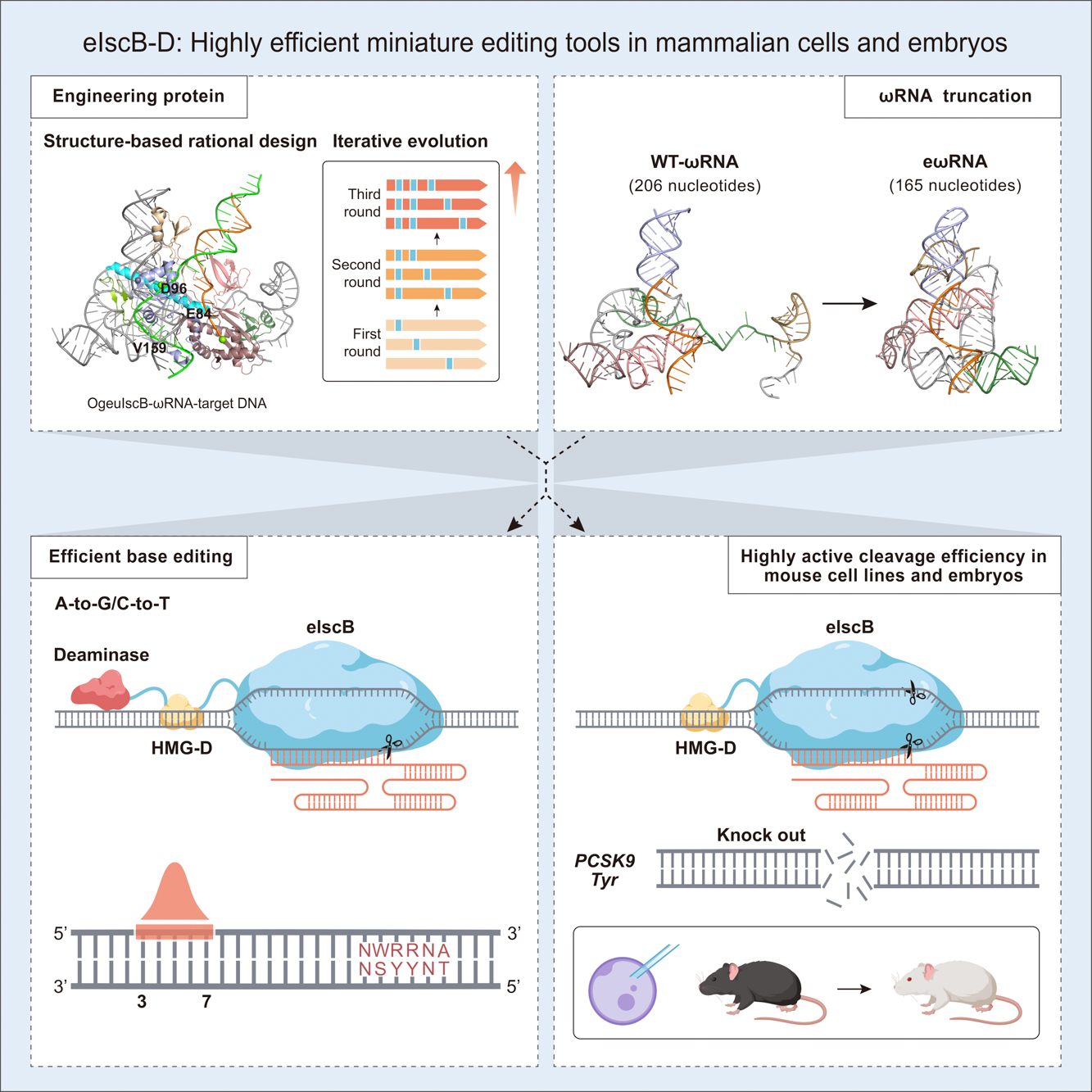
2021年,張鋒團隊通過挖掘和分析發現了一種由 IS200/IS605 轉座子超家族編碼名為 IscB 的核酸酶。作為 Cas9 可能的進化祖先,氨基酸長度僅約為 SpCas9 的三分之一左右,也利用一段非編碼 RNA(ωRNA)引導蛋白識別 DNA。然而,IscB 在哺乳動物細胞中的活性非常有限。以 OgeuIscB 為例,其在 HEK293FT 細胞中編輯效率不到5%。因此,能否通過工程化的改造提高IscB的基因編輯活性,達到與 Cas9 相當的活性是需要解決的首要問題。
為了全面提升 IscB 的編輯效率,研究人員通過蛋白質工程化改造、RNA 結構優化、胚胎注射等技術獲得在哺乳動物細胞及鼠源細胞系中具有超高活性的IscB變體(命名為eIscB-D)。一方面基于結構理性設計在 IscB 蛋白關鍵位置引物氨基酸突變,經過三輪迭代篩選,獲得了增強型 IscB(命名為eIscB)。eIscB 平均編輯效率相較于野生型 IscB 平均可提高7.5倍。此外,研究人員通過融合一個非序列特異性雙鏈 DNA 結合蛋白(HMG-D)提高IscB與目標 DNA 的親和力,高活性 IscB(命名為eIscB-D)的最高編輯效率可達91.3%。另一方面,為了解決野生型 ωRNA 太長而難以進行工業合成的問題,研究人員通過晶體結構分析,對 ωRNA 的不同莖環結構進行改造,最終獲得高活性的 ωRNA(命名為eωRNA)且長度相較于野生型 ωRNA 縮短了20%,大大降低了工業合成的難度。最后優化獲得的 eIscB-D/eωRNA 編輯效率相較于原始 IscB/ωRNA 平均可提升20.2倍。
圖文摘要
此外,先前并沒有研究證明 IscB 在小鼠體內可以產生高效編輯。研究人員首先在小鼠 N2a 細胞系中針對 PCSK9以及 Tyr 基因進行靶點篩選,測序結果表明 eIscB-D 在 PCSK9-sg29 這一靶點可實現58%的編輯效率,在 Tyr-sg21 靶點的編輯效率為47.1%。研究人員隨后通過胚胎注射 eIscB-D/eωRNA 系統靶向 Tyr 基因的1號外顯子,破壞白化基因的表達,成功制備小鼠白化疾病模型。在 F0 代,75%(9/12只)突變小鼠實現高效編輯(平均編輯效率為58.8%),其中有5只產生白化表型,編輯效率接近100%。該研究首次證明了 eIscB-D 不僅可以在鼠源細胞系中產生高效編輯,并且可以通過胚胎注射高效制備疾病動物模型。
|一款迷你單堿基編輯工具:更高效率、更精準
近年來,陸續報道了一系列小型 Cas 蛋白,包括小型 Cas12f 蛋白、其進化上的祖先 TnpB 以及真核同源物 Fanzor。然而,由于 Cas12f 家族只有一個 RuvC 結構域,難以用于堿基編輯、先導編輯等依賴于缺口酶的衍生技術。
由于 IscB 普遍長度在400-500個氨基酸,與胞嘧啶脫氨酶(APOBEC)、腺苷脫氨酶(TadA)或逆轉錄酶(RT)融合,構建可由單個 AAV 完整包裝的迷你堿基編輯器(BE)或先導編輯器(PE),從而實現安全高效的體內遞送。
研究人員通過在 RuvC 結構域關鍵催化位點引入丙氨酸突變,通過篩選,開發了 IscB 切口酶(eIscBH339A),并與腺苷脫氨酶(TadA-8e)和胞嘧啶脫氨酶(hA3A*)分別融合開發出超高活性的微型單堿基編輯器 eiABE 和 eiCBE,最高位編輯效率分別可達到73.6%和79.2%。
總的來說,該團隊開發了高活性的 eIscB-D/ eωRNA 系統,并基于此獲得了高效的迷你單堿基編輯工具(eiABE和eiCBE)。最后,通過胚胎顯微注射技術高效地構建了白化小鼠疾病模型。這個結果極大地增加了單個 AAV 載體安全高效遞送迷你基因編輯工具的可能性,豐富了基因編輯工具的應用場景,為將來用于體內基因治療提供了高效的候選技術。

IscB小組合影
華東師范大學博士研究生薛念念,碩士研究生洪迪珊,博士后張丹以及碩士研究生王茜為本文的共同第一作者,華東師范大學為第一單位,華東師范大學李大力研究員,朱一凡、王立人副研究員為本文的共同通訊作者。華東師范大學生命科學學院劉明耀教授、宋高潔研究員、關玉婷研究員,以及新加坡國立大學胡純一教授等對本項研究提供了重要支持。該研究受到了上海市教委前沿科學基地、科技部重點研發計劃、國家自然科學基金以及上海市教委科技創新計劃和浦江人才計劃等支持。
附:
論文鏈接:https://www.sciencedirect.com/science/article/pii/S1097276524005835?via%3Dihub
來源|生命科學學院、科技處 編輯|鄧安之 編審|郭文君
