在抗擊癌癥的長期戰斗中,科研人員一直在追求一種理想的治療方法,即能夠精準消滅腫瘤細胞而不損害健康組織。近期的一項研究成果讓科研人員對實現這一目標更加充滿信心。
2024年4月11日,華東師范大學生命科學學院葉海峰團隊在Cell Reports Medicine 雜志上發表了題為Sonogenetics-controlled synthetic designer cells for cancer therapy in tumor mouse models的研究論文。他們提出了一種創新的腫瘤治療手段——利用超聲波控制的細胞“生物炸彈”,對腫瘤發起精準攻擊。

Cell Reports Medicine 雜志刊發華東師范大學葉海峰團隊研究成果
隨著合成生物學技術的飛速發展,一種智能活體藥物遞送系統應運而生,為癌癥等疾病的精準治療帶來新希望。這些智能活體藥物如同微型藥物工廠,能夠針對人體內的炎癥、感染和腫瘤等特定病灶,感應預設的信號輸入,并精確地作出響應。
團隊采用了聲遺傳學的策略,即利用超聲波控制細胞行為的一種技術。研究人員設計構建了一種基于溫敏型轉錄抑制因子TlpA39的超聲調控的基因表達系統(SINGER),攜帶該系統的工程化細菌可以在超聲波的刺激下,局部升溫到39攝氏度,即可精確地啟動特定基因的高效表達。
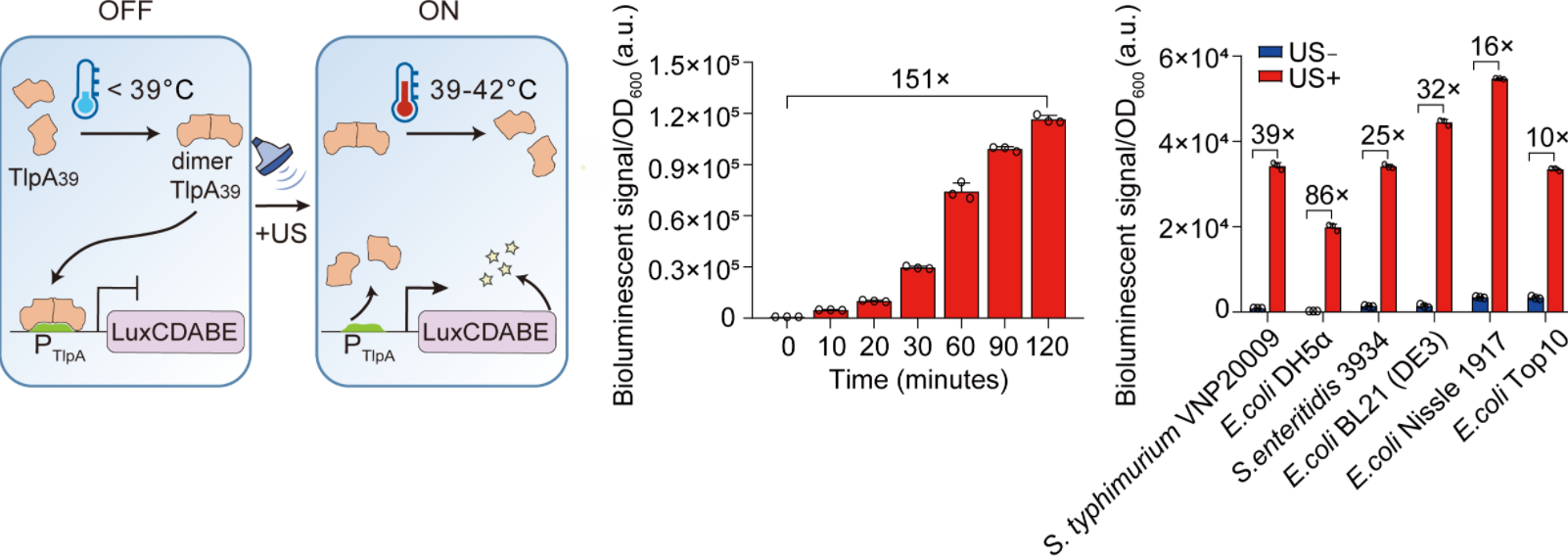
圖1. SINGER系統的設計與表征
當受到超聲波的刺激時,工程化細菌被激活,釋放出能夠誘導腫瘤細胞凋亡的Azurin蛋白和免疫檢查點抑制劑PD-L1 nb。這種時空可控的調控機制確保了治療效果直接針對腫瘤細胞,同時最大程度地保護了周圍的健康細胞不受傷害。
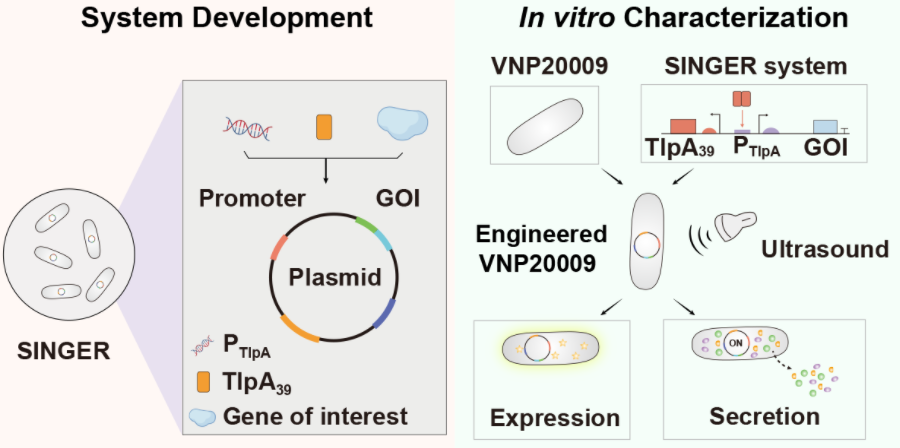
圖2.超聲調控定制化工程菌的開發
工程化細菌通過瘤內注射或靜脈注射的方式遞送到體內,可以選擇性地在腫瘤缺氧和壞死區域定殖與增殖。在超聲波的精確控制下,這些“生物炸彈”在腫瘤內部被激活,原位表達釋放出治療藥物,有效抑制腫瘤的生長,甚至能夠徹底清除腫瘤。
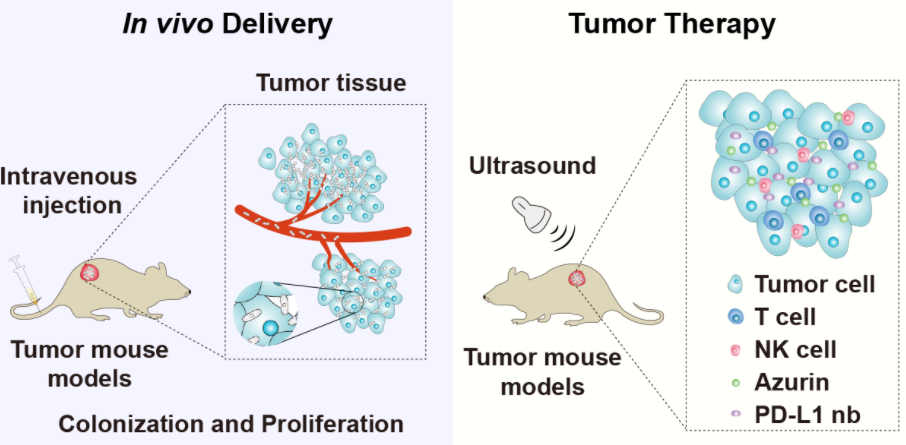
圖3. 超聲調控定制化工程菌在腫瘤治療中的應用
在多種小鼠腫瘤模型中,這種超聲調控的工程細菌展現出了顯著的抗腫瘤效果。通過瘤內直接注射或血液輸送,工程細菌能夠精確定位到腫瘤區域,并在超聲波的誘導下,在腫瘤核心區域釋放能夠誘導腫瘤細胞凋亡的Azurin蛋白等強效抗癌蛋白,直接殺傷腫瘤細胞。此外,研究人員還探索了聯合使用Azurin和免疫檢查點抑制劑PD-L1 nb的治療策略,發現該策略不僅引發了腫瘤細胞的凋亡,還激活了身體的免疫系統,從而達到了雙重抗癌效果。
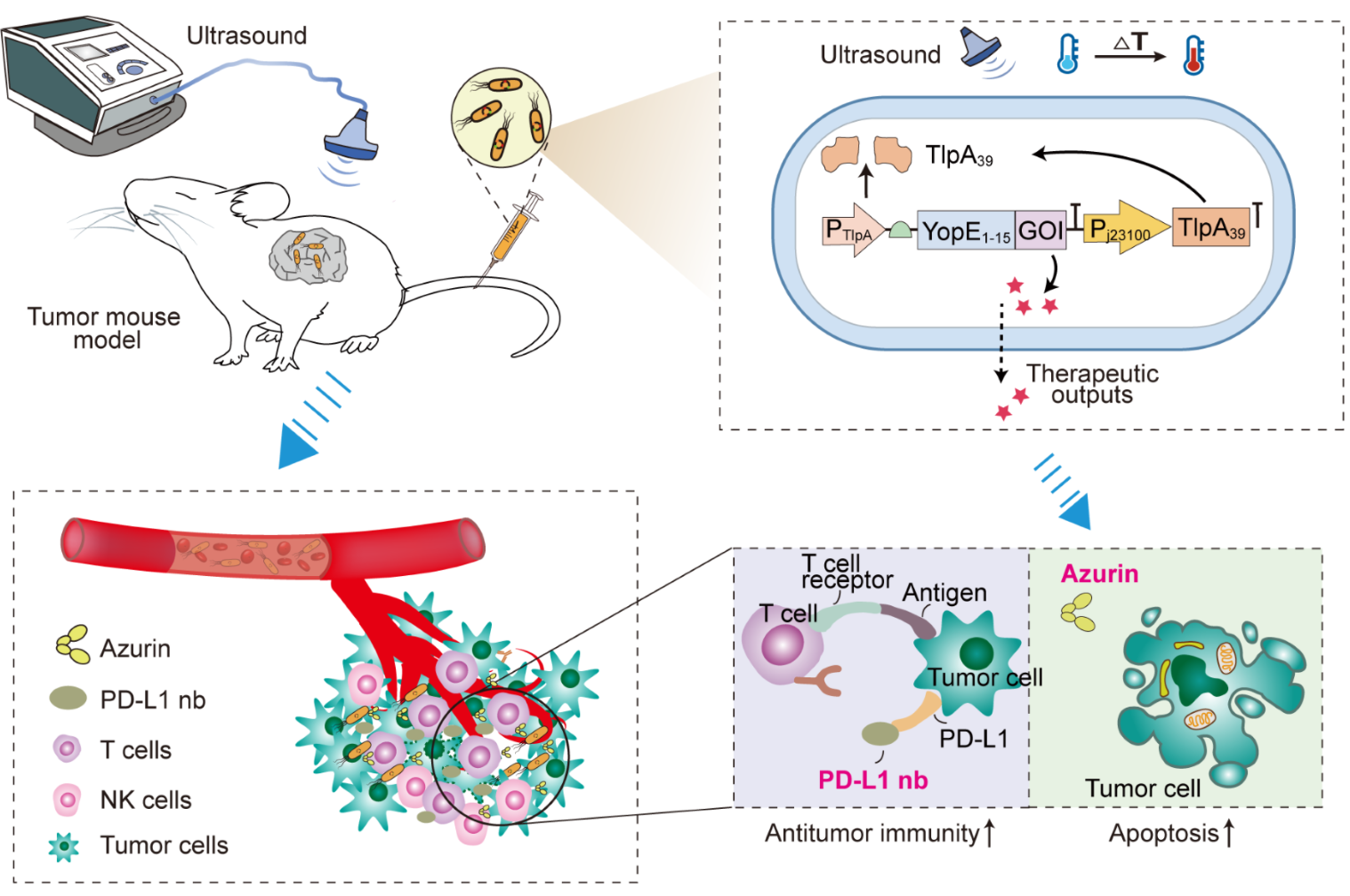
圖4. 超聲調控定制化工程菌用于腫瘤治療機制示意圖
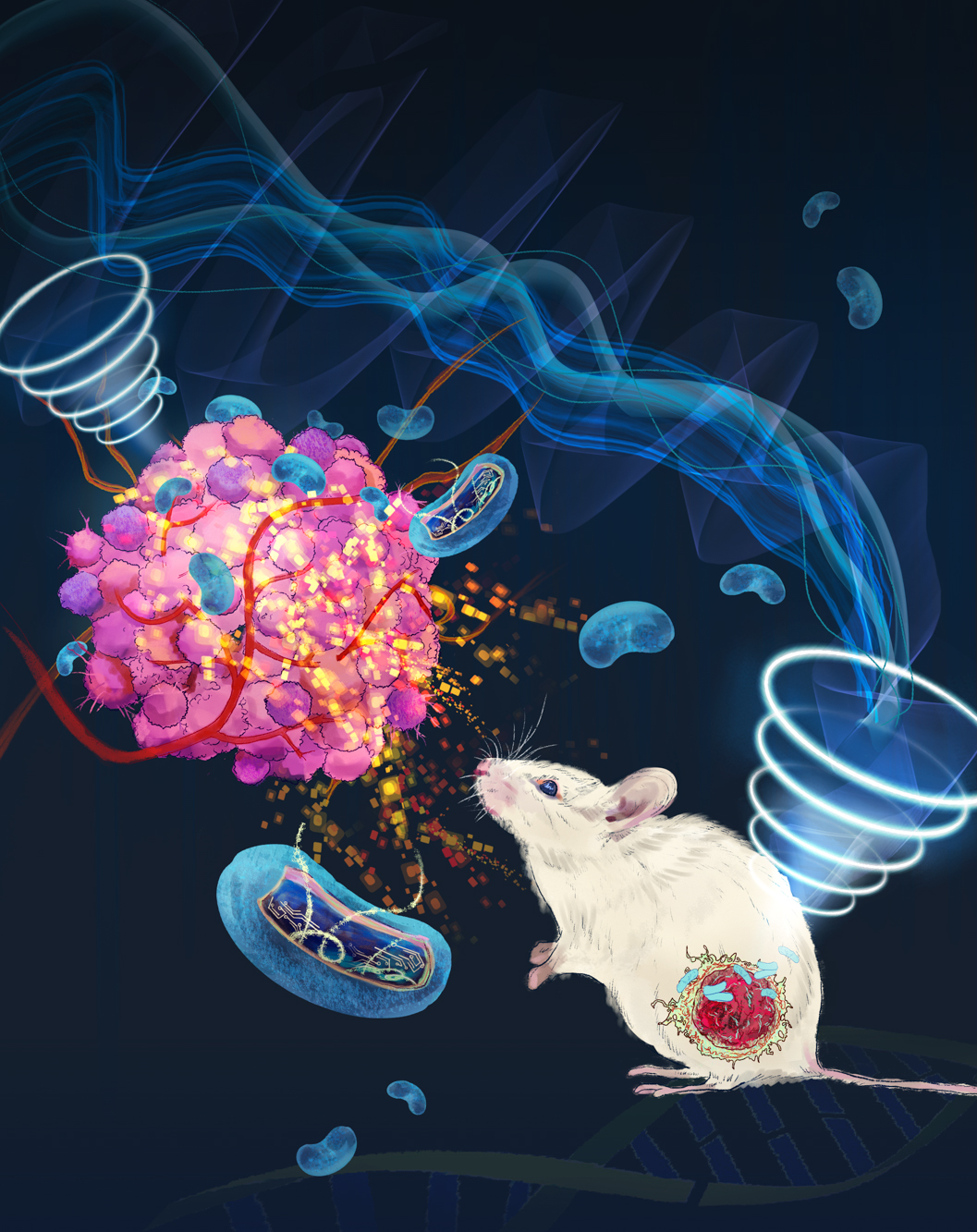
該設計圖描繪了超聲波刺激工程細菌在腫瘤組織內局部產生并釋放治療蛋白抗腫瘤的作用過程
初步研究顯示,這種基于超聲波控制的定制細胞療法在動物模型中表現出良好的安全性和有效性。盡管當前技術仍面臨著向深部或轉移性腫瘤更精確遞送的挑戰,但隨著研究的深入和相關技術的完善,超聲控制的工程細菌療法有望開辟精準醫療的新天地,為患者提供更精準、更安全的治療選擇。在不久的將來,超聲控制的細胞“生物炸彈”有望成為抗擊腫瘤的有力武器,為廣大癌癥患者帶來新的曙光。

華東師范大學2023屆博士畢業生高天,2022級博士研究生牛靈雪和2023屆博士畢業生武鑫為本文的共同第一作者。華東師范大學生命科學學院葉海峰研究員和管寧子副研究員為本文的共同通訊作者。該研究受到了上海市科委、國家自然科學基金委、國家重點研發計劃的支持。
附:
論文鏈接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00182-4
媒體報道:https://news.sciencenet.cn/htmlnews/2024/4/520701.shtm
來源|生命科學學院、科技處 編輯|沈婷鈺 編審|郭文君
