在現代藥物開發和生物化學領域,靶向蛋白質降解(TPD)技術已經成為一個重要的創新平臺,它通過利用細胞自身的蛋白質降解機制來調節生物體內特定蛋白質的活性和豐度,為治療包括癌癥和神經退行性疾病在內的多種疾病提供了新策略。盡管TPD技術展現出巨大潛力,但它也面臨著挑戰,包括蛋白降解劑的非目標選擇性不足,分子量過大和以Degron為基礎的系統需要對靶蛋白進行預先修飾的限制等等。

Molecular Cell 刊發葉海峰研究團隊科研成果
針對這些問題,2024年3月12日,華東師大生命科學學院、上海市調控生物學重點實驗室、醫學合成生物學研究中心的葉海峰研究團隊在Molecular Cell雜志上發表了題為A programmable targeted protein degradation platform for versatile applications in mammalian cells and mice的研究論文。他們首先通過篩選獲得了一種蛋白降解效率高達80%-90%的E3泛素連接酶Trim21截斷變體(ΔTrim21),隨后開發了一系列基于ΔTrim21的可控靶向蛋白降解系統,實現化學小分子、光調控細胞和小鼠體內的靶向蛋白降解(圖1)。

圖1 ΔTrim-TPD系統的設計及其應用
研究工作主要通過以下四個步驟逐一展開:
1、設計、構建基于ΔTrim21的靶向蛋白降解系統
ΔTrim-TPD系統靈感源于Trim-Away技術,該技術通過顯微注射引入特定抗體到細胞內,借助E3連接酶Trim21實現目標蛋白的特異性識別與降解。在此基礎上,研究人員通過篩選一系列的Trim21變體,發現了降解效率更高的Trim21截斷變體(ΔTrim21),且無明顯副作用。以此為基礎,他們開發了基于ΔTrim21的靶向蛋白質降解系統(圖2)。
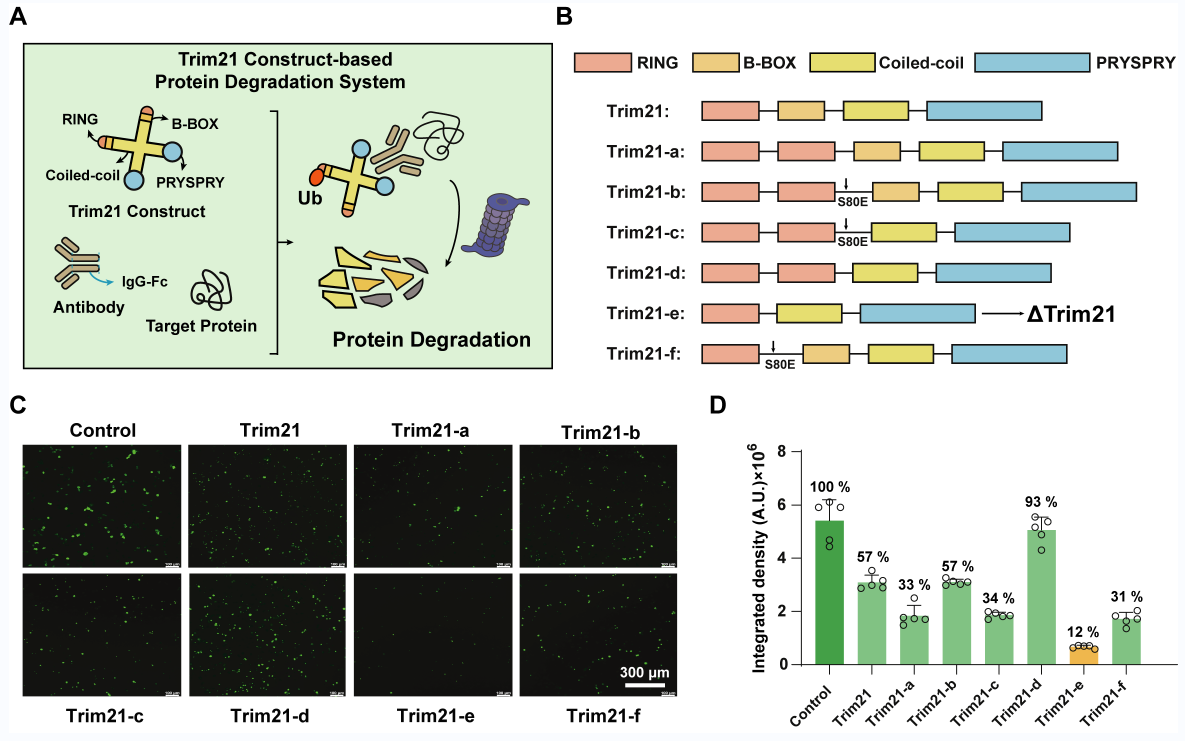
圖2 設計、構建基于ΔTrim21的靶向蛋白降解系統
2、紅光調控的靶向蛋白降解系統(RedΔTrim-TPD)的設計和抗病毒應用
為了實現對靶向蛋白降解的精準可控,他們通過紅光誘導的REDMAP系統來調控ΔTrim21的表達,開發了紅光調控的靶向蛋白降解系統—RedΔTrim-TPD。他們將感染HSV-1-GFP病毒的細胞轉染RedΔTrim-TPD后,成功使用紅光觸發降解系統在12 h內降解病毒包裝蛋白gD以抑制HSV-1病毒增殖(圖3)。

圖3 RedΔTrim-TPD系統及其抗病毒應用
3、臨床小分子藥物調控的靶向蛋白降解系統(ChemΔ2Trim-TPD)的設計和基因編輯應用
為了實現分鐘級別高效誘導蛋白降解,他們開發了化學誘導的翻譯控制蛋白降解(ChemΔ2Trim-TPD)系統。當藥物存在時,納米抗體和ΔTrim21被聚合在一起,在30分鐘內實現藥物控制的靶向蛋白降解。基于此,他們將其應用于控制基因編輯,設計了三種ChemΔ2Trim-TPD介導的CRISPR-Cas9系統:轉錄抑制、轉錄去抑制或基因片段刪除,用于控制人類細胞中不同的感興趣基因(圖4)。
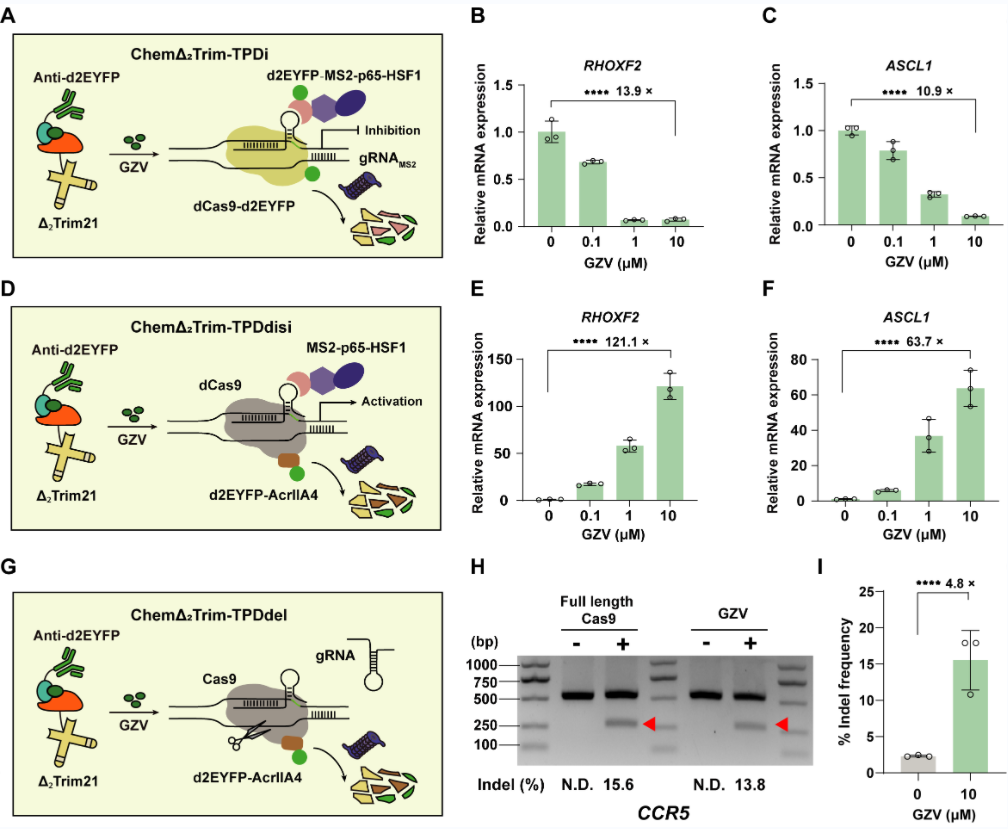
圖4 ChemΔ2Trim-TPD介導的基因編輯
4、OptoΔ2Trim-TPD系統的開發和腫瘤的抑制作用
研究人員利用Magnets系統設計了藍光調控的OptoΔ2Trim-TPD系統,原理與ChemΔ2Trim-TPD一致,他們開發的OptoΔ2Trim-TPD系統可以在30分鐘內實現對不同半衰期、不同分子量的靶蛋白的快速降解。最后,他們通過慢病毒將OptoΔ2Trim-TPD系統遞送到小鼠腫瘤組織。當小鼠暴露在每天30分鐘的藍光下時,OptoΔ2Trim-TPD系統使腫瘤細胞中靶蛋白(PD-L1和c-Myc)降解,從而抑制腫瘤生長,顯著延長了小鼠生存期(圖5)。

圖5 OptoΔ2Trim-TPD在黑色素瘤小鼠模型中腫瘤生長的抑制作用
總之,研究人員開發的基于ΔTrim21的可控靶向蛋白質降解系統進一步拓展了蛋白質降解領域的研究,提供了一種快速、高效、可控的胞內蛋白和跨膜蛋白靶向降解手段,為細胞生物學基礎研究提供了強大的工具,并有望推進基因和細胞的精準治療。

示意圖

葉海峰教授研究團隊
該論文的通訊作者為華東師范大學生命科學學院葉海峰教授。2021級博士研究生馬小丁和博士后尹劍麗為該論文的共同第一作者。
該研究工作得到了國家自然科學基金委和上海市科委的支持。
附:
論文鏈接:https://www.cell.com/molecular-cell/abstract/S1097-2765(24)00138-2
來源|生命科學學院、科技處 編輯|沈婷鈺 編審|郭文君
